Сабақтың аты: §7,3-7,4 Бор постулаттары. Сутегі тектес атом үшін Бор теориясы
Жалпы мақсаты: Бор постулаттары. Сутегі тектес атом үшін Бор теориясы жайлы мағлұмат беру. Бор постулаттары. Сутегі тектес атом үшін Бор теориясының формулаларын есеп шығаруда қолдана білуге үйрету. Топта бағалауға баулу.
Күтілетін нәтиже: Бор постулаттары. Сутегі тектес атом үшін Бор теориясы жайлы мағлұмат алады. Бор постулаттары. Сутегі тектес атом үшін Бор теориясының формулаларын есеп шығаруда қолдана білуге үйренеді. Өзін-өзі дұрыс бағалай алатын болады.
Сабақтың түрі: Аралас сабақ
Пән аралық байланыс: химия, математика, тарих
Сабақтың әдіс-тәсілдері: Әңгіме, лекция, дискуссия, топпен жұмыс.
Сабақтың көрнекіліктері: интерактивті тақта, атомдық физика саласында еңбектері сіңген оқымыстылардың портреттері, Менделеевтің химиялық элементтерінің периодтық таблицасы, жарықтың спектрге жіктелуіне арналған құралдар, сутегі атомының энергетикалық деңгейлері және сәуле шығару өтулері, спектрдің түрлері (тұтас (жолақ), жұтылу және шығару).
Сабақтың барысы:
І. Ұйымдастыру (3 минут)
1.1. Сәлемдесу
1.2. Сынып оқушыларына жағымды ахуал туғызу
1.3. Түгелдеу
1.2. Топқа бөлу (1,2 сандарына байланысты 2 топқа бөлінеді)
Сіздің тобыңызда топ басшысын анықтаңыз. Жұмыс төмендегідей жоспармен жүреді:
Берілген мәтінді оқып, топпен бірлесе отырып, талқылайды және әр топтың бақылаушысы жасаған жұмыстарға сәйкес бақылау парағын жүргізеді.
1. Бақылаушының бағалау парағы
| № | Оқушының аты-жөны |
|
|
|
|
| 1 | Үй тапсырмасы |
|
|
|
|
| 2 | Міндетін атқару |
|
|
|
|
| 3 | Топтық жұмысқа атсалысуы |
|
|
|
|
| 4 | Есеп шығару |
|
|
|
|
2. Әр оқушы өзіне жүктелген рөлдің міндеттерін атқарады.
3. Топ пікірлерін тыңдау.
ІІ. Үй тапсырмасын сұрау (5 минут)
1. Атом құрлысы жайында не білеміз?
2. Атом құрлысы жайында ғылымдырлың көзқарасы қандай?
3. Атом ядролық үлгісі жайында не білеміз?
ІІІ. Білімді жан-жақты тексеру. Оқушылар алдарындағы кестені толтырулары керек (4 мин)
- 1895 ж. Неміс ғалымы В. Рентген рентген сәулелерін ашты.
- 1896 ж. Б. Беккерель уран тұздарының сыртқы күштің әсерінсіз белгісіз сәуле шығаратындығын және ол сәуленің рентген сәулесіне ұқсастығын байқаған.
- 1898 ж. М. Складовская – Кюри мен П. Кюри радиактивті элементтер – полоний мен радийді ашты.
- 1911 ж. Э. Резерфорд атомның ядролық моделін жасады.
-1913 ж. Н. Бор сутегі атомына арналған стационарлық күйіне арналған постулаттарын ұсынды.
- 1932 ж. Орыс физигі Д.Д. Иваненко ядро құрылысы туралы болжам (гипотеза) жасады.
- 1933 ж. Ирен және Фредерик Жолио – Кюрилер жасанды радиактивтілікті ашты.
- 1934 ж. П.А. Черенков пен С.И. Вавилов сұйықтарда қозғалатын Электрондардың жарқырау құбылысын ашты.
- 1935 ж. Орыс ғалымы Курчатов ядролық изомерия құбылысын ашты.
- 1938 ж. Ф. Жолио-Кюри уран ядросын нейтронмен атқылығанда, оның екі бөлікке бөлінетінін ашты.
ІV. Жаңа материалды қабылдауға әзірлік, мақсат қою (2 минут)
Бүгінгі негізгі мақсатымыз оқулық бойынша Сутегі атомының Бор жасаған моделімен танысамыз.
Талқылау үшін сұрақтар беріледі (3 минут)
1. Бор постулаттары жайында не білесіңдер?.
2. Атомның стационар күйлері жайлы не білеміз?
Ү. Топтық жұмыс (10 минут)
1-топ. Бордың бірінші постулаты
2- топ. Бордың екінші постулатын талдау
Денелердің шығаратын сәулесінің түрлі түске жіктеліп немесе сызықтар түрінде көрінуін спектр деп деп атайды.
Спектрлер: 1. жолақ (тұтас) спектрді – тығыздығы өте үлкен денелер шығарады. 2.шығару сызықтық спектрін – тығыздығы өте аз қызған газдар немесе плазма береді. 3.жұтылу сызықтық спектрі – өте қызған денеден шыққан жарықты сирелген газ арқылы өткізген кездегі қара жолақтар.
Химиялық элемент қандай толқын ұзындығында сәуле шығарса, сондай толқын ұзындығында сәулені жұтады.
Заттың химиялық құрамын оның сызықтық спектрі арқылы анықтау әдісі спектрлік анализ деп аталады. Бұл әдісті 1859 жылы Г. Кирхгоф пен бунзен экспериметтік зерттеулерге енгізді. Спектрлік анализдің көмегімен гелий, германий, және скандий элементтері ашылды.
1855 жылы И. Бальмер сутегі спектрін талдай отырып, оның көзге көрінетін толқын ұзындықтарын анықтайтын формуланы көрсетті: ν=R()
Мұндағы λ –толқын ұзындығы λ=364,6 нм, n=3,4,5,6. Бұл формула Бальмер сериясы деп аталады. И. Ридберг 1890 жылы Бальмер сериясындағы спектр сызықтарының жиілігін анықтау формуласын ұсынды: v=R. Мұндағы, n=3.4.5.6. мұндағы R=1.0968*10-7 m-1 – Ридберг тұрақтысы деп аталады.
Эксперимент жүзінде алынған жоғарыдағы нәтижелер мен формулаларды теориялардың бірде-біреуі түсіндіре алмады. Бұл тұйықтан шығудың жолын 1913 жылы Нильс Бор өзінің екі постулаты арқылы түсіндірді.
Бордың бірінші постулаты
Атом ерекше стационарлық күйде бола алады. Ондай күйде атом электромагниттік толқын (сәуле) шығармайды әрі жұтпайды..
Бордың екінші постулаты
Электрон энергиясы Еn стационар орбитадан энергиясы Еm стационар орбитаға ауысқанда, энергия кванты жұтылады не шығарылады. Ол энергия мына түрде анықталады:
hν=En-Em
Энергетикалық диаграмма
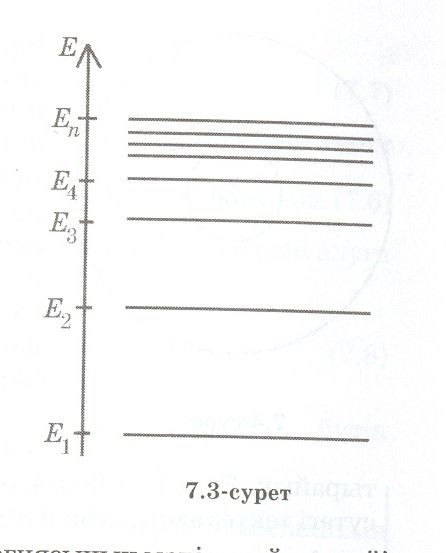
Атомның әрбір энергиясының мәніне сәйкес күйі горизонталь сызықпен бейнеленеді, бұл сызықты энергетикалық деңгей деп атайды.
Атомның энергиясы ең аз күйін негізгі күй, басқалары қозған күйлер деп аталады.
Топтың пікірлерін тыңдау, барлық айтылған ой-пікірлерді бағалаудың мақсатына сәйкестендіру
VІ. Топтық жұмыс (13 минут)
1. Егер жапқыш кернеуі 1,6 В болған кезде тоқтаса, онда фотоэлектрондардың ең үлкен жылдамдығы қандай?
2. Егер рентген түтігі 150 кВ кернеуде жұмыс істесе, онда электронның кинетикалық энергиясы неге тең болар еді?
3. 19779 Au элементінің құрамында қанша электрон, қанша протон, қанша нейтрон бар?
ҮIІ. Кері байланыс (не үйрендім, не қиын болды) (3 минут)
VIII. Үйге тапсырма. §7,3-7,4 Бор постулаттары. Сутегі тектес атом үшін Бор теориясы (2 минут)
Жолдаған: Еңбекшіқазақ ауданы,
О.Жандосов атындағы орта
мектеп интернат КММ,
Физика пәнінің мұғалім Сағынған Қаншай


